Laboratorio de Balanceo
BALANCEO DE ECUACIONES
OBJETIVOS
- Reforzar la identificación de los números de oxidación,
- Reconocer cada uno de los compuestos estipulados, manejando las diversas nomenclaturas
- Identificar y manejar los dos métodos de balanceo, tanto u óxido-reducción
- Conocer y aplicar los reglamentos de aplicación
- Reconocer correctamente la cantidad de átomos de cada elemento
- Realizar satisfactoriamente el proceso de balanceo químico
MARCO TEÓRICO
El balanceo se realiza con ecuaciones químicas, pero ¿sabemos que son y que las componen? si tu respuesta es no continua esta lectura.
La reacciones y ecuaciones químicas es un proceso químico en el cual unas sustancias, denominadas REACTIVOS, se transforman en otras sustancias denominadas PRODUCTOS
Las reacciones químicas se caracterizan por
- Un cambio de las propiedades de los cuerpos
- Una variación de energía que se pone de manifiesto en el transcurso del proceso
Clases de reacciones químicas
- Combinación o síntesis
Ocurre cuando se unen dos o más sustancias para formar una sola sustancia, A +B → AB
- Descomposición o análisis
Se presenta cuando a partir de un compuesto se producen dos o más sustancias AB → A + B
- Desplazamiento o sustitución
En estas reacciones, un elemento sustituye y libera a otro elemento presente en el compuesto.
A + BC → AC + B
- Intercambio o doble sustitución
Al reaccionar dos compuestos estos intercambian sus elementos y se producen dos nuevos compuestos.
AB + CD → AC + BD
- Combustión
Las reacciones de los elementos con el oxígeno son tan comunes que puede ubicarse como una clase determinada
- Exotérmicas
Son aquellas que se efectúan con desprendimiento de calor, se denomina reacción exotérmica a cualquier reacción química que desprenda energía, ya sea como luz o como calor.
- Endotérmicas
Las endotérmicas absorben el calor.
Los elementos se presentan por símbolos y los compuestos quimicos por formulas, una formula química se simboliza mediante una ecuación química que es una igualdad en la que se representan los reactivos y productos.
Una ecuación química debe equilibrarse de manera cuantitativa relacionando las cantidades de las sustancias que forman parte de la reacción, para ello es necesario igualar la ecuación, esta se encuentra igualada o equilibrada cuando cumple dos leyes o principios químicos
1. LEY DE LA CONSERVACIÓN DE LA MATERIA
La masa de los reactivos debe ser igual al de los productos,ningún átomo puede crearse o destruirse en una reacción química, así que el número de átomos que están presentes en los reactivos tiene que ser igual al número de átomos presentes en los productos.
2. LEY DE LAS PROPORCIONES DEFINIDAS
Las sustancias reaccionan según unas relaciones de peso fijas e invariables, estas proporciones fijas vienen representadas en la ecuación química mediante unos números llamados coeficientes estequiométricos
Es necesario ajustar o equilibrar la ecuación química, existen dos métodos con los que podrás realizar este proceso
MÉTODO DE ENSAYO Y ERROR, TANTEO O SIMPLE INSPECCIÓN
En este método probamos diferentes coeficientes o número de moles con el objetivo de igualar el número de átomos de cada elemento en ambos lados de la ecuación, es decir en los reactivos y productos.
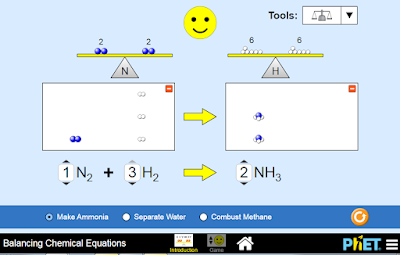
Ejemplo: Al reaccionar el nitrógeno con el hidrógeno para formar amoniaco, establecer la formula y equilibrar la ecuación correspondiente.
1. Se identifican las formulas moleculares y se designa el estado físico del elemento o forma en que se encuentran
Nitrógeno: Gas
Hidrógeno Gas
Amoniaco: Gas
Los estado fisicos de los elementos en las formulas químicas se indican entre paréntesis, tal y como lo muestra la imagen
2. Se identifican las fórmulas de los reactivos a la izquierda y la de los productos a la derecha, separado uno de los otros con una flecha, la cual significa '' produce''.
En las ecuaciones químicas existen diversas composiciones que poseen integrantes o significados, observalo en la imagen
3. Ahora debemos equilibrar la ecuación, hay 2 átomos de nitrógeno en el lado de los reactivos (izquierdo) mientras en el de los productos solo hay 1 átomo del mismo, por lo tanto es necesario
escribir coeficiente 2 al amoniaco
Ten en cuenta que el coeficiente que acompaña al nitrógeno es 1, puesto que al multiplicar este con su subíndice nos va a dar por resultado 2.
4. Se tiene equilibrado los atomos de nitrogeno pero hay tan solo 2 átomos de hidrógeno a la izquierda contra 6 que aparecen en los productos (derecha). Es necesario asignarle coeficiente 3 a la molécula de hidrógeno con el objetivo de equilibrarlas
5. La ecuacion ha quedado equilibrada, el número de átomos de cada elemento se encuentra en igual cantidad tanto en los productos como en los reactivos
MÉTODO DE OXIDO -REDUCCIÓN O REDOX
La oxidación se refiere a:
- La pérdida de electrones por parte de un átomo o un grupo de átomos
- Aumento del numero de oxidacion de un elemento en una forma positiva
La reducción se refiere a:
- La ganancia de electrones que sufre un átomo o grupo de átomos
- Disminucion o reduccion en su número de oxidación
Los procesos de oxidacion y reduccion suceden simultáneamente y nunca de manera aislada, por lo que se les denomina reacciones redox
El metodo de igualacion es el siguiente:
1. Se escribe la ecuacion del proceso y se determina el número de oxidación para cada uno de los elementos de la reacción, escribiendo este valor en la parte superior del símbolo
2. Se establece cuales átomos sufren un cambio en su numero de oxidación y cual de ellos es el oxidado y el reducido
3. Se calcula el numero de oxidacion de cada uno de estos átomos tanto en su forma oxidada, como reducida y se procede a escribir ecuaciones iónicas
4. Se establecen los coeficientes mínimos del oxidante y reductor de tal forma que el número total de electrones ganados y perdidos sea el mismo; para ello multiplicamos en las ecuaciones iónicas el número de electrones por factores adecuados.
5. Se asignan como coeficientes de las sustancias afectadas en la ecuación los factores que se utilizaron para que el número de electrones sea igual.
6. Por ultimo, el equilibrio se logra por el método de ensayo y error.
LABORATORIO VIRTUAL
Materiales:
1. Pagina web
2. Conocimientos previos
Procedimiento:
- Realiza previamente los ejercicios que te brinda la introducción siguiendo las instrucciones y aplicando los conocimientos anteriores
2. Al iniciar los ejercicios es necesario desplegar y utilizar las balanzas que nos presenta la aplicación, puedes utilizarlo como una guia para equilibrar la ecuacion.
- MAKE AMMONIO
En la composición de amoniaco tenemos, nitrógeno que reacciona con hidrógeno para su producción, recuerda seguir el orden de elementos... metales, no metales, hidrogenos y oxígenos.
- SEPARE WATER
- COMBUST METHANE
GAME
- LEVEL 1
- LEVEL 2
- LEVEL 3






































BUEN TRABAJO 5.0
ResponderEliminar